ema 2023 年报,详述审评和监督检查成就 -凯发k8一触即发
发布时间:2024-06-25
文章来源:识林
欧洲药品管理局(ema)于上个月发布其 2023 年度报告,详述了 ema 在去年一年的监管活动,报告采用全新的布局和新的互动功能,可供深入了解 ema 的战略举措以及 2023 年工作重点。
报告和 24 个附件总共 200 多页内容,回顾了 ema 2023 年人用药和兽药审评和监督重点以及 ema 在三大战略领域的关键成就:抗癌药、数据驱动的药品监管以及透明度和沟通。今年的报告有两种格式可供查看,除了传统的 pdf 版本外,新增了允许用户过滤数据并与数据进行交互的电子版本(https://www.ema.europa.eu/en/annual-report/2023/index.html),阅读和检索起来更加方便。
药品和监管活动
2023 年,ema 建议批准了 77 个人用药,其中 39 个含有新活性物质。许多药品代表了其治疗领域的重大进展。ema 还推荐批准两个预防呼吸道合胞病毒(rsv)引起的下呼吸道疾病的疫苗。ema 还建议批准首个使用突破性基因编辑技术 crispr/cas9 治疗两种罕见血液疾病(β 地中海贫血和严重镰状细胞病)。此外,ema 还通过了两个关于供欧盟以外国家使用的药品的推荐意见。
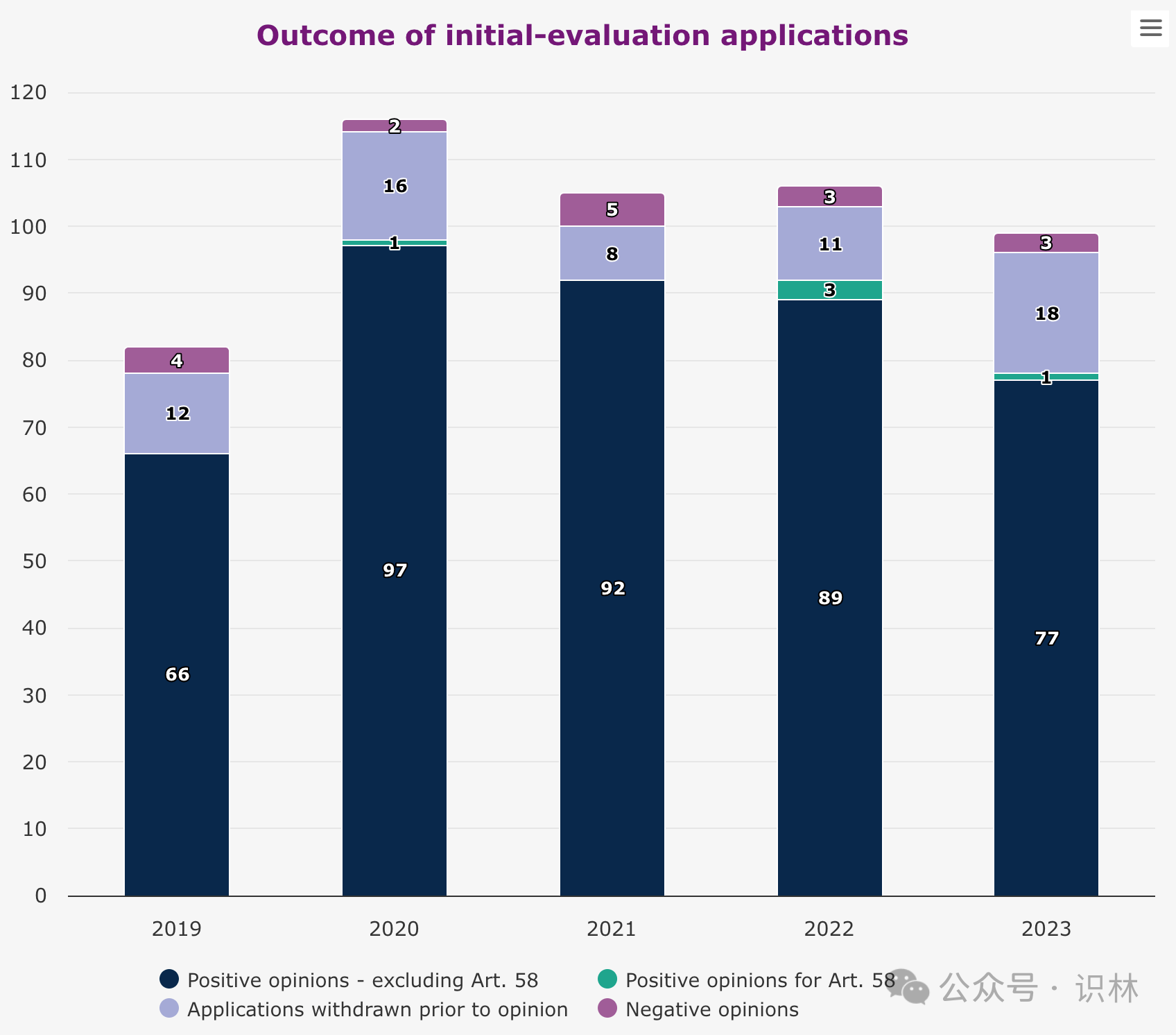
2023 年建议批准的 77 个药中,3 个通过加速审评(仅用于解决存在未满足医疗需求的药物)获得上市许可建议,8 个药获得有条件上市许可建议(有条件许可允许在临床数据比通常要求的更少的情况下提前批准),1 个药是在特殊情况下获得许可建议(允许患者使用在标准许可下无法获批的药物)。17 个药获得孤儿药认定,8 个药在获得上市许可建议之前失去孤儿药资格,即,仍被建议批准,但不再是孤儿药。另外,ema 推荐扩展 77 项已获许可药物的治疗适应症。
兽药领域,ema 推荐了 14 个药品上市许可,其中 9 个含有新活性物质,与 2022 年相比增加了三倍。其中 9 个为疫苗,包括 6 个新型生物技术疫苗。
另外,报告中对药物不良反应(adr)数据的报告显示出随着新冠疫情的缓解,ema 的工作量已经恢复正常。去年,从欧洲经济区(eea)发送的集中授权产品(cap)不良反应报告数量下降至约 50 万份,这一数字还不到 2022 年报告数量的一半,与疫情前的数据更加一致。
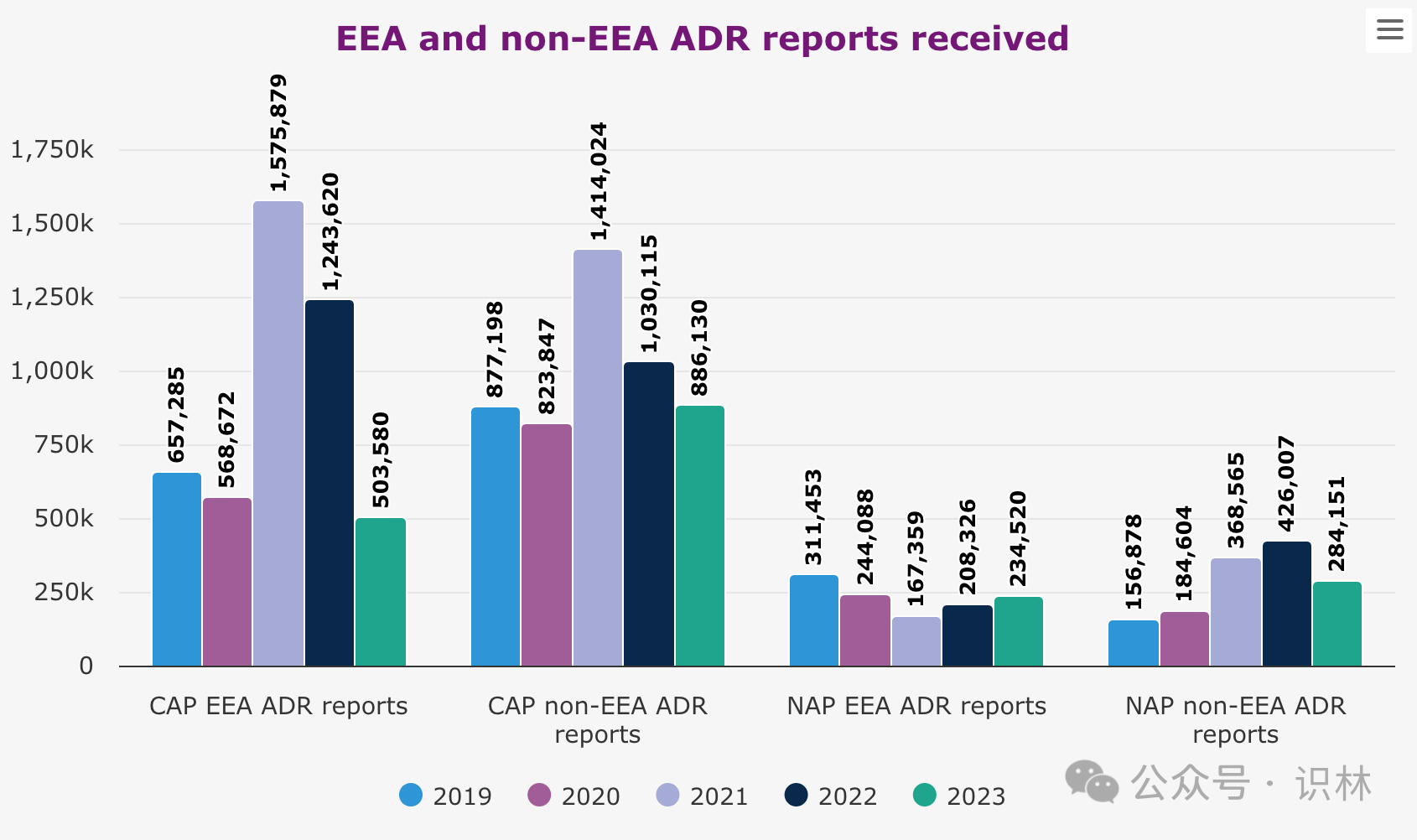
ema 表示,疫情期间,包括患者报告在内的 adr 报告率大幅上升,是大规模疫苗接种运动的结果,也是人们提高对报告任何疑似副作用重要性的认识的结果。
检查
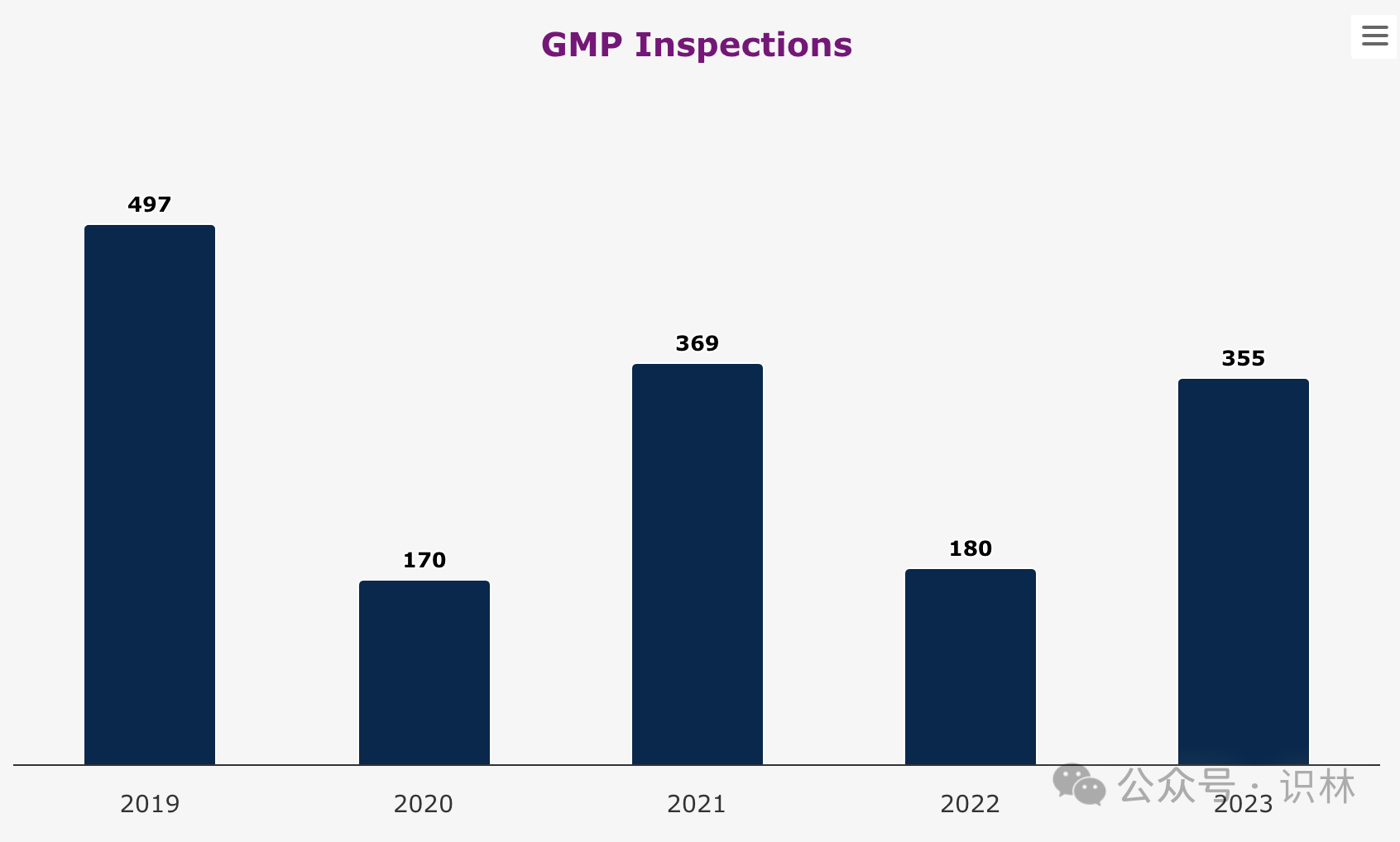
欧洲药品监管网络中,ema 本身不执行检查,检查责任在各国主管机构,但 ema 发挥重要协调作用。2023 年 ema 要求的 gmp 检查数量上升至与 2021 年相当的水平。
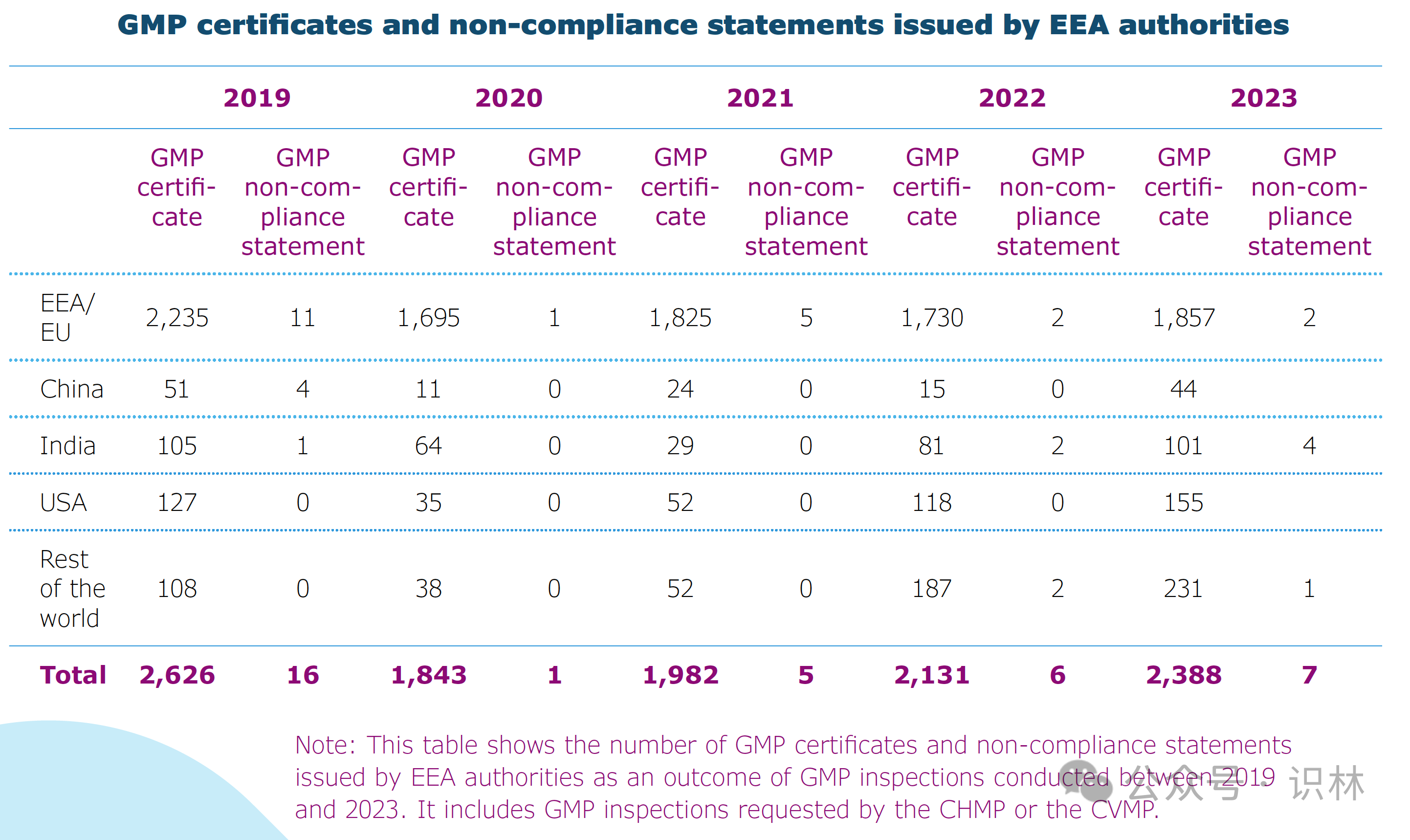
eea 主管机构执行的 gmp 检查中有 7 次检查导致发出不合规声明。下图显示了 2019-2023 年间由各 eea 主管机构执行的 gmp 检查之后发出的 gmp 证书和不合规声明情况。
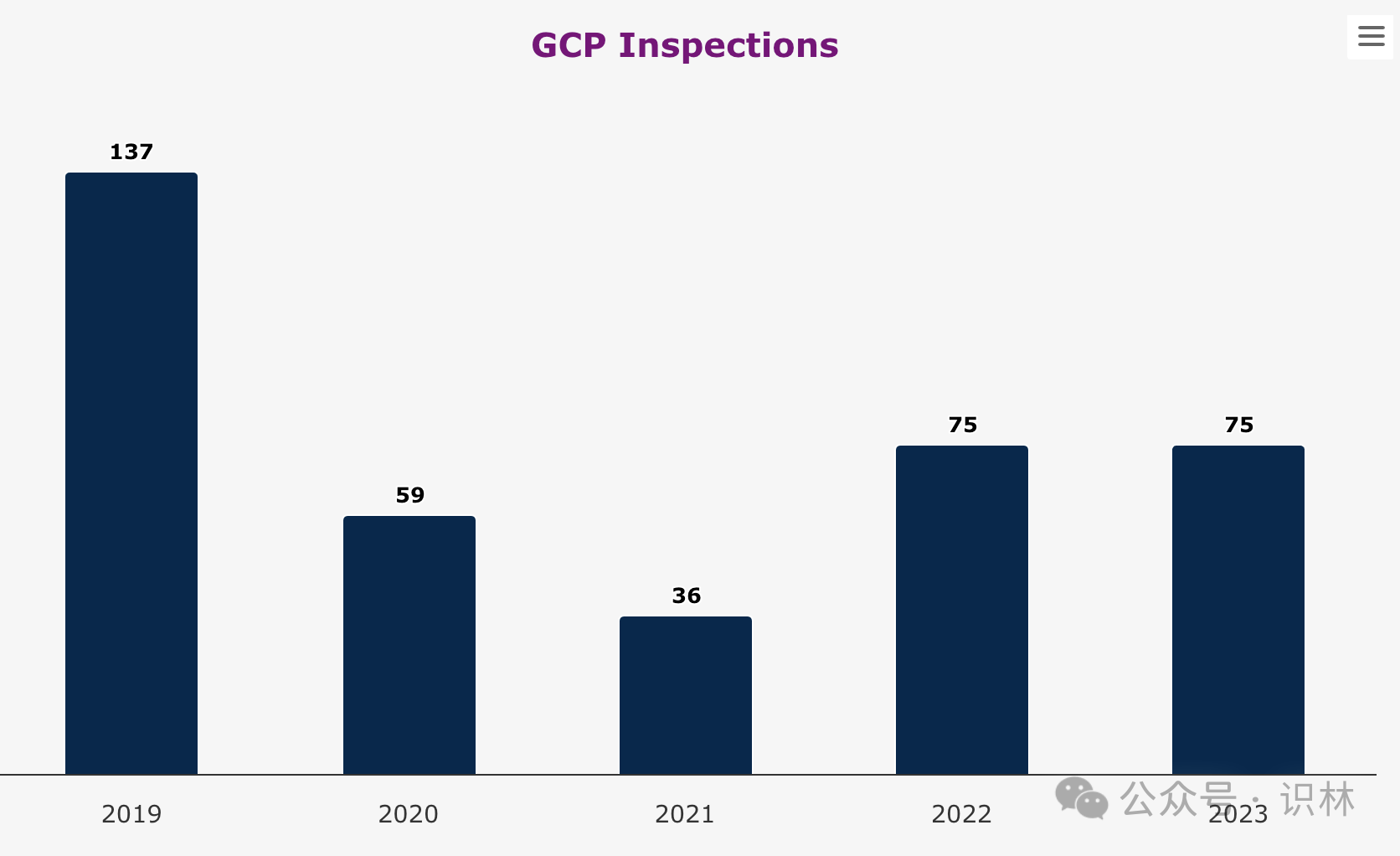
2023 年 ema 要求进行的 gcp 检查为 75 次,与 2022 年持平,比 2021 年和 2020 年增多,但仍低于疫情前水平。
抗癌药探路者计划
2023 年,ema 启动了一项名为“抗癌药探路者”的新计划,进一步支持可能对患者治疗产生重大影响的抗癌药的开发和批准。该计划探讨了 ema 如何应用从新冠疫情中汲取的经验来改进整体药品审评。报告概述了“探路者”计划及其三大支柱的进展:加速对药品的审评、加强与利益相关者的对话,沟通获益和风险。
更多内容请阅览 2023 年报全文。
免责声明 本文系转载,仅做分享之用,不代表平台观点。图片、文章、字体凯发k8一触即发的版权等均属于原作者所有,如有侵权请告知,我们会及时处理。
原文链接: https://mp.weixin.qq.com/s/x7tmulgtvuxdak-ynftaww
作者 :识林-椒