2023年全球主要监管机构药品法规指南概览 -凯发k8一触即发
发布时间:2024-02-05
文章来源:识林
2023年,全球主流监管机构新发了数千份法规指南等技术资料。剔除官方资讯、通知和宣传类内容后, 6个主要监管机构发布了1207篇法规指南类文件。其中,中国药监557篇(含cde 196篇),fda 394篇,欧盟药监131篇,who 85篇,pic/s 30篇,以及ich 10篇。
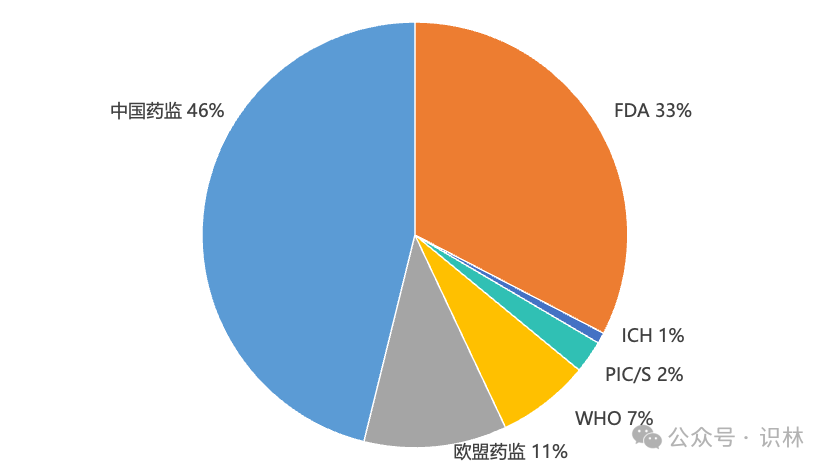
图1:主要监管机构法规指南发布数量
从数量上可以看出,自审评审批制度改革以来,我国在一以贯之地倾力构建坚实的药品监管法规体系,而长期处于监管领先地位的fda也在不断完善、持续变革。
不过,数量与影响力不能划等号。pic/s的30篇几乎都是纲领性的gmp指南文件,从制剂到原料,从放射性药品到血液制品,以及确认、验证、物料、计算机化系统等等,涵盖面极广。nmpa已成为pic/s正式申请者,这些gmp文件对国内药企也越来越重要。识林翻译了其中大部分常用文件,供用户查阅学习。ich的10篇则涉及生命周期各个阶段,e6 gcp,m7致突变杂质,s12基因治疗非临床生物分布,还有q系列的q2,q5a,q9以及q14等。
任何一篇法规指南问世,总会对相关企业和岗位产生影响。但不可否认,总有一部分法规指南数量更多,涵盖面更广,影响力也更大,代表着当前监管重点,也是药企的焦点所在。
下面就以发布数量和以识林用户为代表的业界点击量,做个简要概览。
药监部门最关注什么?
图2基于法规指南在药品生命周期中的分布进行归类,横轴是文件总数。从中大致可以看出国内国际(主要以欧美为代表)药监在2023年的监管倾向。
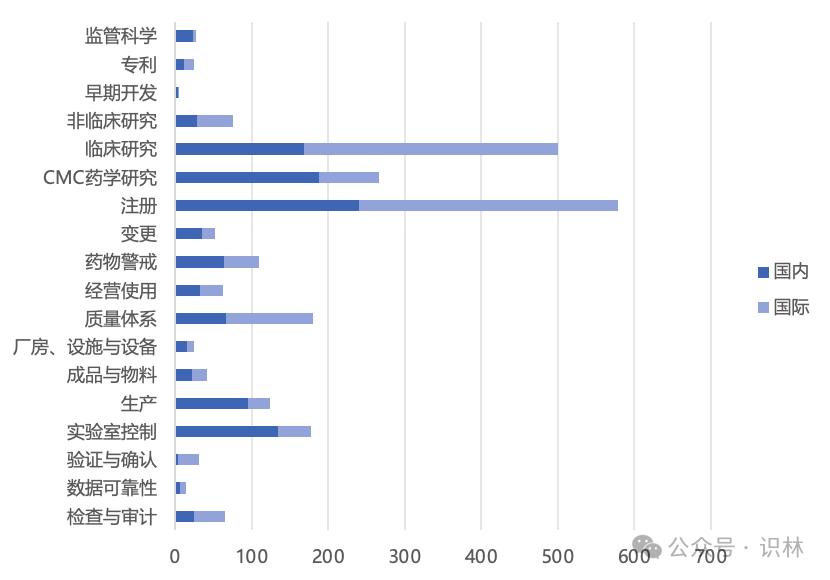
图2:国内和国际法规指南分类对比
比较明显的区别是,中国药监在“cmc药学研究”、“实验室控制”、“生产”这类生产制造板块发布较多的法规指南,相比之下,国际药监重点在于“非临床研究”和“临床研究”这类研发阶段的内容。
中外都比较关注的领域有“注册”、“质量体系”、“检查与审计”等。其中,与注册相关的内容尤其多,包括流程、资料、电子申报形式,也包括与变更相关的注册内容。
以上是国内国际的对比,接下来再看中国与fda。当前我国药企已纷纷踏入药品创新周期,除了国内市场,最为关心的就是fda的动向,以争取中美双报上市。此外fda多年在药品监管的科学性和创新性上保持领先,也值得借鉴和学习。
细看中美,创新是共同热点,fda指导be,nmpa指导cmc
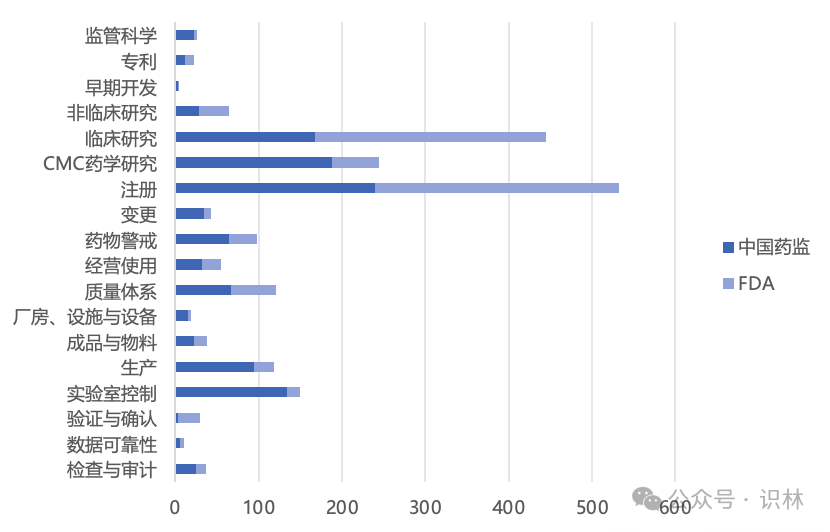
图3:中国药监和fda法规指南分类对比
图3仅保留中国药监和fda,可以大致看出中美之间的监管导向差异。
有一点需要澄清的是,“临床研究”里,fda虽然发布了多达277份指南,占了总数一半以上,但细究起来,其中有154份是be指南。尽管生物等效性是临床试验的一种,但更多是“仿制药”的属性。与之相对,nmpa(含cde)发布临床类法规指南168份,其中仅29份与be相关。fda一贯聚焦于创新中最为关键的临床领域,但nmpa近几年步伐不停,正迎头赶上。
拉近“镜头”,审视两个机构发布的临床技术类法规指南。nmpa发布的文件里,最受关注是“新药获益风险评估”(征求意见半年即落地),“抗肿瘤抗体偶联药物”,“真实世界证据”,“临床安全性评价”,“以患者为中心”。而fda也恰在今年定稿了“获益风险评价”指南(征求意见已两年),其他关键词还有“主方案”,“抗肿瘤加速批准”,“治疗蛋白药物相互作用”,“罕见病考量”,“儿科药”,“去中心化临床”等等。一个总体印象是,国内尚在搭建临床技术指南体系的过程中,许多指南都是从无到有,注重填补空白;而fda则是在已经相当成熟的体系上做增量,更多关注的是如何利用临床来加速批准,促进罕见病和儿科药物开发,并引入新颖的临床试验方法论,如主方案和去中心化,可谓从有到优。另一个印象则是,国内临床指南从征求意见到正文落地的节奏明显更快。
再看差异较大的“cmc药学”(包括密切相关的“生产”和“qc”)方面。fda除了跟进ich的m7致突变杂质等指南,几乎没有发布与cmc直接相关的指南。诸如advanced manufacturing technologies designation program(先进制造技术认定计划)这类文件,并非指导药企做药学研究,而是在更高层面促进新技术的应用。与之相对,nmpa发布多个有关化学药的“配伍稳定性”,“口服液剂型”和“滴眼剂”药学指南,针对各类复杂的个药的“药学研究技术指导原则”(如化学合成多肽,抗体偶联,溶瘤病毒产品,腺相关病毒载体类,乃至人源干细胞等等),以及临床iii期前会议的“药学共性问题”。从qbd的理念出发,好的药学研究是一套可靠的工艺和质量标准的基础,从而也是上市后gmp合规的基础,nmpa不遗余力指导药企很有必要,换个角度也可视为国内药企在药学上还有进步空间。
行业关注什么?
首先,从点击量前500(排除了影响面较小因而点击较低的部分)的法规指南分布看,对六个监管机构的数量分布和平均点击量进行统计,以识林用户为样本估计制药行业的最关注的热点法规指南,见图4。

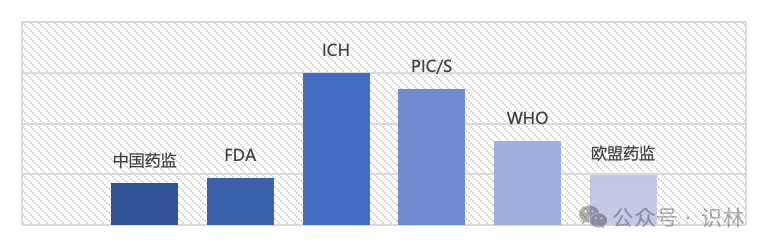
图4:行业关注的2023法规指南机构数量分布(上)和平均点击量(下)
可以看到,行业关注了更多的国内法规指南,fda占据次席也不意外。平均点击量中,数量极低的ich和pic/s指南却有着相当高的平均点击量,其原因在于两家机构发布的内容适用几乎所有的主流药品市场,为药企所必读。who的市场虽非主流,但其指南具有全球属性,也是很好的参考内容。
接下来,继续以“微观”的视角看看中国药监和fda对不同监管主题的关注。主题纷繁芜杂,在此,仅根据点击量和发布数量综合考虑,挑选了14个相对有代表性的主题供参考,见图5。
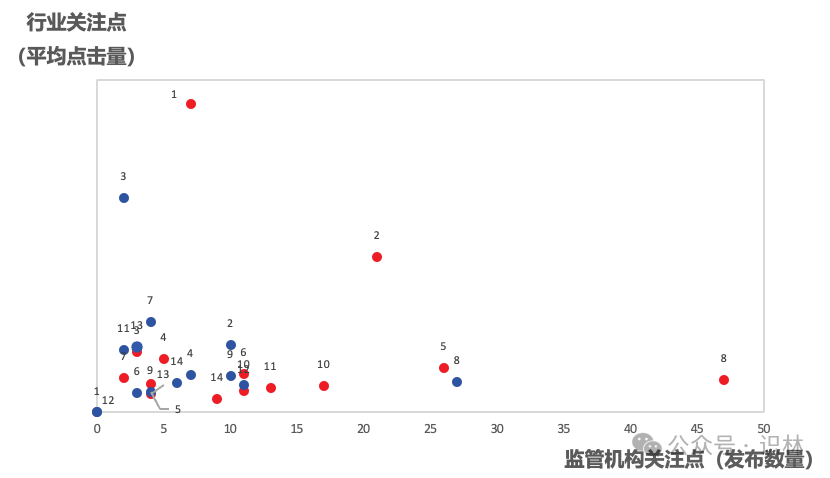
图5:中美药监法规指南部分主题的点击和数量分布
注:红点为中国药监,蓝点为fda,右侧主题编号顺序是按中国药监平均点击由高到低
1 持有人和委托生产;2 检查;3 亚硝胺;4 加快审评;5 上市后变更;6 儿童药;7 污染;8 说明书;9 真实世界;10 先进疗法;11 沟通交流;12 放射性药品;13 药品短缺;14 以患者为中心
在这个坐标系中,横轴是该主题对应的法规指南的数量,纵轴则是全年平均点击量,且中美放在了一起(通过颜色区分),分别代表“监管机构关注度”和“行业关注度”。
意料之中,国内法规指南年度最热主题是“持有人和委托生产”(编号1)。5月24日nmpa公开征求《关于加强委托生产药品上市许可持有人监管工作的通知(征求意见稿)》意见。本文曾在网络上流传,业界反响很大,失望者有之,调侃者有之,比较突出的一个声音是所谓“开倒车”。但无论是开什么车,对开车的药企来说,比较务实的做法,还是该研究这个车具体怎么开才能安全抵达。到10月23日,132号文正式落地,主旋律是更具体的要求,更严格地管控,保留“鼓励生物制品持有人具备自行生产能力”的字样。从法规本身看,监管趋严是肯定的,也是应该的。业界与其操心“能不能做”,还不如把时间更多地花在“怎么做得更好”上,用事实和数据证明自己足以承担mah的责任。反观fda,未发布任何与mah和委托生产密切相关的文件,毕竟这种持有和生产分离的权责机制在大洋彼岸早已成为常态。
国内药监的其他主题中,“说明书”(编号8)法规指南数量较多(其中包含nmpa要求个药修订说明书的文件),尤其是首次提出了“无障碍”和“适老化”的要求,虽然离fda的说明书体系还有距离,但这也标志着国内药品监管从控制逐步走向促进,更多考虑患者需求。同理还有“以患者为中心”(pfdd,编号14),cde于7月份定稿了三份pfdd指南,包含“临床设计”、“临床实施”和“获益-风险评估”,涵盖药物开发、设计、实施和决策的过程,不过点击相对偏低,体现出企业临床试验的关键决策掌握在少数人员手中。
fda法规指南中最受关注的主题是“亚硝胺”(编号3),集中在recommended acceptable intake limits for nitrosamine drug substance-related impurities guidance for industry(亚硝胺原料药相关杂质的推荐可接受摄入量限度)。自从2018年亚硝胺进入药企和监管视野以来,问题不断升级,影响的品种也越来越多。研究并控制亚硝胺类杂质已是cmc的必修课。国内最近一份亚硝胺指南,还是2020年5月份的《化学药物中亚硝胺类杂质研究技术指导原则(试行)》,药企需结合中美欧的大量指南来处理亚硝胺类杂质。
两个监管机构最关注,行业也最关注的是“检查”(编号2)。国内药品检查的纲领性法规,2021年5月发布的《药品检查管理办法(试行)》迎来修订,最为显著的改动是检查结论和评定标准,此外,《药品检查综合评定报告书》的监督检查信息将及时更新到“药品安全信用档案”中。这意味着,检查不再只是过关了事,任何结论都可能影响企业信用,进而关系到未来“基于风险的检查”。此外,nmpa配套132号文发布了《药品上市许可持有人委托生产现场检查指南》,将重点法规的实施通过明确的检查要求加以固化。
fda发布多份检查类文件,于1月份发布cpgm7356.843 postapproval inspections(批准后检查),6月发布mapp 5014.1 rev.1 understanding cder's risk-based site selection model(了解 cder 基于风险的场地选择模型),10月发布remote interactive evaluations of drug manufacturing and bioresearch monitoring facilities guidance for industry(药品生产和生物研究监测设施的远程交互式评估),从内部工作规范到外部指南,阐述fda检查的流程,“基于风险的方法”的具体措施,以及疫情期间兴起的所谓“远程检查”的进一步应用。
新的一年,继续以务实的心态对待法规指南
以上图表和简要分析,并非严谨学术研究,仅从识林视角,为大家回顾2023制药业法规指南全景提供了参考。
2024年,识林将一如既往关注来自更多机构,涵盖更完整主题的法规指南。大家可以预期中外药监部门将继续推动监管变革,细化具体监管要求,并通过出台法规指南促进前沿产品(如,细胞基因治疗和各类生物递送方法)和技术(如ai)的发展。
监管机构和研究机构在法规指南方面的努力,既是对行业的规范和引导,也源自产业的需求和激励。这种激励,体现在业界对法规指南的关注和尊重,并能基于科学和风险运用法规指南。业界有此务实心态,识林和更多志同道合的业务机构和专家所专注的各类法规指南研究工作,才更有价值。
免责声明 本文系转载,仅做分享之用,不代表平台观点。图片、文章凯发k8一触即发的版权均属于原作者所有,如有侵权请告知,我们会及时处理。
原文链接:https://mp.weixin.qq.com/s/ud_utxu4-l_wo07j6i2gaa
作者:识林-实木